基于定量成像信号传导的干细胞来源心肌细胞自适应脉动流
- 2024-02-28 09:34:30
体内内皮细胞(EC)持续暴露于血流的机械微环境中,流体剪切力在EC行为中发挥着重要作用。需要产生生理和病理相关搏动流的新方法来理解不同剪切力下EC行为。本文展示了***种自适应泵(Adapt-Pump)平台,通过基于定量成像的信号传导,从人多能干细胞衍生的心脏球体(CS)中产生搏动流/脉动流。Adapt-Pump系统产生的搏动流可以重现独特的CS收缩特性,准确模拟对临床相关药物的反应,并模拟CS在流体机械刺激下的收缩变化。我们发现,在长QT综合征衍生的病理性搏动流下分化的EC表现出异常的EC单层组织。这种Adapt-Pump平台为心血管系统建模和提高我们对不同机械微环境下EC行为的理解提供了***种强大的工具。
体内血管微环境包括持续暴露于血流剪切力,这在血管形成和维持血管功能方面发挥着重要作用。搏动性血流由左心室周期性收缩产生,并维持在整个动脉以及静脉和毛细血管的特定区域。血流与心室收缩紧密相关,因此心律失常会影响外周血流模式。内皮细胞(ECs)排列在血管腔内,因此与恒定流相比,搏动性血流为这些ECs提供了更相关的体内微环境。大量研究表明,体外搏动性血流和恒定流对ECs有不同的影响,包括EC形态和排列、基因表达、粘附蛋白分布、细胞增殖和凋亡。搏动性血流的脉动频率和峰值振幅也在EC形态和蛋白表达方面发挥着重要作用。此外,流体剪切力显著影响分化和分化后的血管壁。在分化过程中,脉动剪切力的影响尚未得到很好的表征。EC分化涉及多个血管形成过程,包括血管发生和血管生成,而这些新的血管形成过程受到剪切力的关键影响。EC在心血管系统中有多种功能,包括屏障保护、内分泌信号和炎症反应。EC功能障碍可导致动脉粥样硬化和血栓形成等血管疾病,以及心肌梗死和卒中。因此,开发具有更生物学相关的脉动流廓线的心血管模型,以更好地模拟血管发育和疾病,是非常重要的。
搏动性血流由于其对细胞和组织的生物力学效应,是体外研究血管生物学的关键组成部分。以前体外研究内皮细胞行为的方法使用气动或压电压力泵和模拟波形产生搏动性血流。然而,这些以前方法的基础泵技术缺乏时间分辨率,无法重现心脏收缩产生的时变血流的频率内容。此外,这些以前研究的模拟搏动波形不能提供反馈流或药物治疗引起的波形实时变化。因此,这些以前的方法无法在体外研究动态生物力学变化对心血管系统的长期影响。虽然以前的研究表明,与恒定血流相比,搏动性血流改变了内皮细胞的功能和形态,但由于目前体外模型的局限性,无法确定病理性搏动性血流(如长QT综合征)对内皮细胞的患者特异性影响。因此,需要***种新的体外模型来产生脉动流,以捕捉药物治疗或患者特异性病理流的细微流体差异,以促进心血管系统的药物筛选和疾病建模。
人类多能干细胞(hPSC)来源的心肌细胞已被用于模拟基因突变对心肌细胞功能的影响,并能够重现病理生理学表型19。然而,这些突变对更广泛的心血管系统(包括血管)的影响尚未在当前hPSC来源的心肌细胞疾病模型中进行研究。此外,hPSC来源的心肌细胞提供了无限的和可重复的细胞来源,以测试心肌细胞在药物治疗和机械刺激下收缩的变化。此外,它们可以用于模拟包括LQTS在内的多种心脏疾病的表型心脏收缩。心肌细胞收缩的关键特征,包括频率和振幅,与搏动血流密切相关。至关重要的是,它们可以通过高速定量成像和信号转导转化为信号,以产生生物相关的搏动血流。
我们展示了***种新型的自适应泵(Adapt-Pump)系统,基于患者特异性hPSC衍生心脏球体(CSs)的收缩产生生理和病理相关的脉动流。我们开发了基于定量成像的信号传导,以记录CSs的自发周期性收缩,并以高保真度作为微流体脉动流驱动收缩波形。我们使用Adapt-Pump从不同hPSC系的CSs中产生脉动流,包括健康人胚胎干细胞(hESC)衍生的CSs和患者特异性LQTS诱导的多能干细胞(iPSC)衍生的CSs。然后,我们解决了药物治疗对CS收缩的影响,并准确地在微流体脉动流中重现这些收缩。我们还展示了实时Adapt-Pump(rtAdapt-Pump),并解决了CS收缩对微流体机械刺激的瞬时响应。Adapt-Pump还被用于将脉动流应用于EC祖细胞,我们发现LQTS衍生的脉动流在EC分化过程中诱导了异常的细胞组织。该Adapt-Pump系统可以通过基于定量成像的信号传导从hPSC衍生的CSs产生生理或病理相关的搏动流,这是***种新技术,使心血管系统的集成模型前所未有。Adapt-Pump可用于研究心脏疾病在临床相关药物治疗下产生的各种机械微环境下心肌细胞和EC的综合行为。
在这里,hPSC-CSs收缩剖面的定量成像和高速微流体泵结合到Adapt-Pump系统中,以产生生物驱动的脉动流,以促进心血管系统的建模。以前产生脉动流的方法是基于慢压泵和模拟波形,这不能完全复制ECs经历的体内机械微环境。这里展示的Adapt-Pump系统可以重现正常和患病心脏波形之间的差异,包括高时间分辨率的可变脉动幅度、持续时间和频率。
Adapt-Pump系统还可以捕获心脏药物治疗后脉动流的动态变化,重现体内心脏药物反应,并可以实时执行,以了解CS收缩的反馈机制。我们已经证明,该系统可以模拟与生物相关的脉动流。在这里,我们使用缩放因子转换CS收缩期间横截面积的变化,以模拟心脏脉动流的输出压力。我们的2D图像不反映CS轴向尺寸的变化,因此未来可以使用3D成像来提供CS收缩的体积变化。在未来的研究中,应该考虑更复杂的计算模型,以将CS收缩转换为特定条件下的流动力学(例如,不同的血管位置和发育阶段)。与本系统未建模的脉动流动力学有关的重要因素包括与主动脉瓣的相互作用、周围血管系统和血管弹性。
此外,通过使用0.2 mm-ibidi μslide和***大输入压力1 bar,该自适应泵系统的剪切力范围为0 dyne/cm2至约30 dyne/cm2。然而,可以通过使用更高的输入压力或更小的微通道来实现更高的剪切力。该系统的时间分辨率由Elveflow泵决定,其***小响应时间为0.09秒。这些规格限制了可以用该系统测试的应用程序。此外,对于长期实验,细胞培养基必须由Eveflow MUX再循环装置进行再循环,该装置具有开关阀门,可周期性地暂时中断脉动流。
总的来说,该系统可用于模拟心脏收缩对药物治疗和体外反馈流的实时响应,研究心肌细胞和EC在与心脏疾病相关的机械微环境下的行为,并集成到生物驱动的循环系统的芯片器官系统中。基因缺陷iPSCs已被用于体外疾病建模,包括LQTS模型。我们证明了从不同hPSCs产生的3D CSs重现了其基因型的心律特征,包括ESC源CSs的正常心脏收缩和LQTS iPSC源CSs的周期性拉长收缩。心律失常导致的异常流量可能会影响EC生物学38,但现有的产生体外脉动流的技术缺乏生物相关性,因为它们使用的是合成的心脏收缩波形。我们的方法结合hPSC-CSs、高速定量图像分析和快速信号转导,产生适应hPSC基因型和药物治疗效果的脉动流。
体内的ECs持续暴露于脉动血流的流体机械刺激,而流体剪切力影响ECs的行为和分化。我们发现脉动流显著提高了ECs的分化效率,这与先前的报道***致,即剪切力可以诱导ECs分化。我们还发现脉动流增加了细胞核的厚度,这与先前的报道***致,即随着流体流动,ECs的核形状发生变化。这些核形态学的变化可能是ECs对剪切力响应的***个指示。脉动流还增加了细胞大小,改变了内皮细胞黏附分子CD31和机械传感器PIEZO1的分布,这表明ECs结构受到脉动流的影响。脉动,包括频率和振幅,在EC蛋白表达和形态学中发挥重要作用。已知紊乱的流动会影响ECs的行为,包括EC周转率、低密度脂蛋白渗透性、动脉粥样硬化和基因表达。然而,由于缺乏与心血管疾病相关的搏动流产生方法,以前没有对异常搏动流和EC行为之间的关系进行表征。通过本文提出的Adapt-Pump系统,LQTS产生的搏动流在EC祖细胞分化过程中被应用于EC组织,导致EC组织异常。然而,LQTS患者不会持续经历超过48小时的异常搏动流,相反,这些患者在***生中会周期性地经历心律失常。先天性心脏病引起的这些异常搏动流对EC生物学的长期影响尚不清楚,但我们的概念验证EC分化研究表明,异常搏动剪切应力可以显著影响EC行为。
这些研究中使用的hPSC-CS来源的脉动流也反映了不同心脏疾病之间波形的细微差异,这可以为研究心血管疾病和心脏药物对心脏收缩和内皮细胞的力学后果提供***个强大的平台。 后续对Adapt-Pump系统中细胞的分子和遗传特征的研究可以提高我们对生理和病理条件下心脏和内皮细胞的理解,指导改善患者的治疗。
脉动和稳态流是通过连接到真空泵(-1930 mbar)和空压机(6890 mbar)的压力控制器(Elveflow OB1 MK3)产生的。该控制器提供了重现球形收缩波形所需的快速压力调制(9 ms响应时间,35 ms稳定时间,122 μbar压力分辨率)。本研究中使用的控制器配置了两个通道,输出压力从-900 mbar到1000 mbar。对于流量验证研究,其中***个通道连接到储液池,用于通过流道产生单向流动。对于长期实验,使用了***个再循环回路,包括两个通道,每个通道连接到***个储液池和***个流量循环阀(Elveflow MUX Injector),这是***个6端口/2位置阀门,允许在两种配置之间快速切换。这使得在两个储液池之间再循环介质时,可以通过流道保持单向流动。聚四氟乙烯PTFE管(1/16“内径)用于在储液池和流道之间传输液体介质。使用自定义脚本控制压力控制器和流量开关,通过流道产生脉动流。所有泵控制均使用MATLAB 2018b (MathWorks)实现。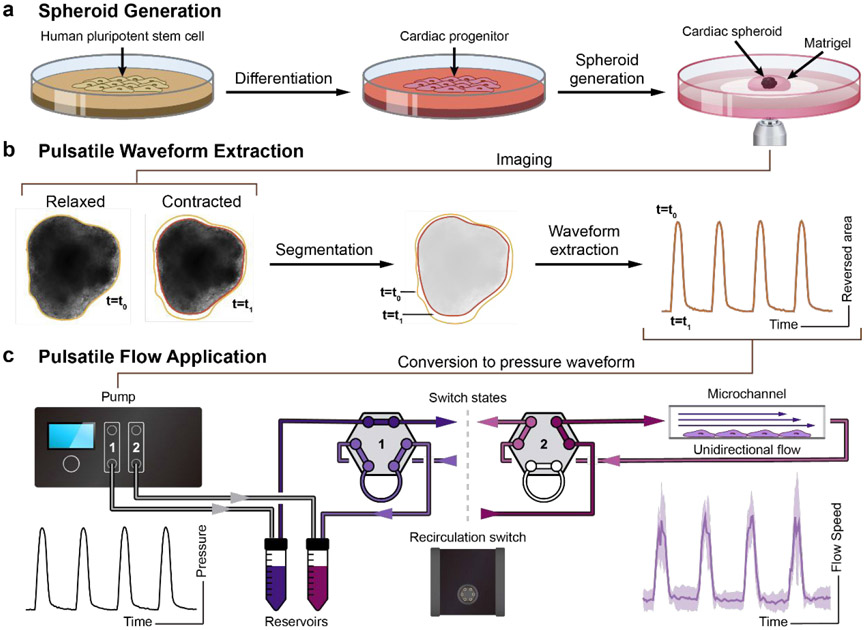
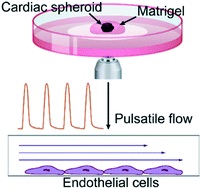
图1:产生脉动流的工作流程示意图。(a)奇异hPSCs在mTeSR1中播种并扩增2天。向心脏祖细胞分化遵循先前的协议,采用连续的Wnt激活和抑制。心脏球体(CS)由心脏祖细胞生成,并嵌入Matrigel中,用于进***步的心脏收缩成像。(b)hPSC衍生的CS成像。使用定制脚本分析这些时间序列图像,并从CS收缩中提取脉动波形。(c)收缩波形转换为脉动波形,并发送到Elveflow OB1泵。Elveflow MUX注射系统用于循环细胞培养基。流体脉动剪切应力应用于ibidi μ-slides中播种的EC祖细胞,用于EC分化研究。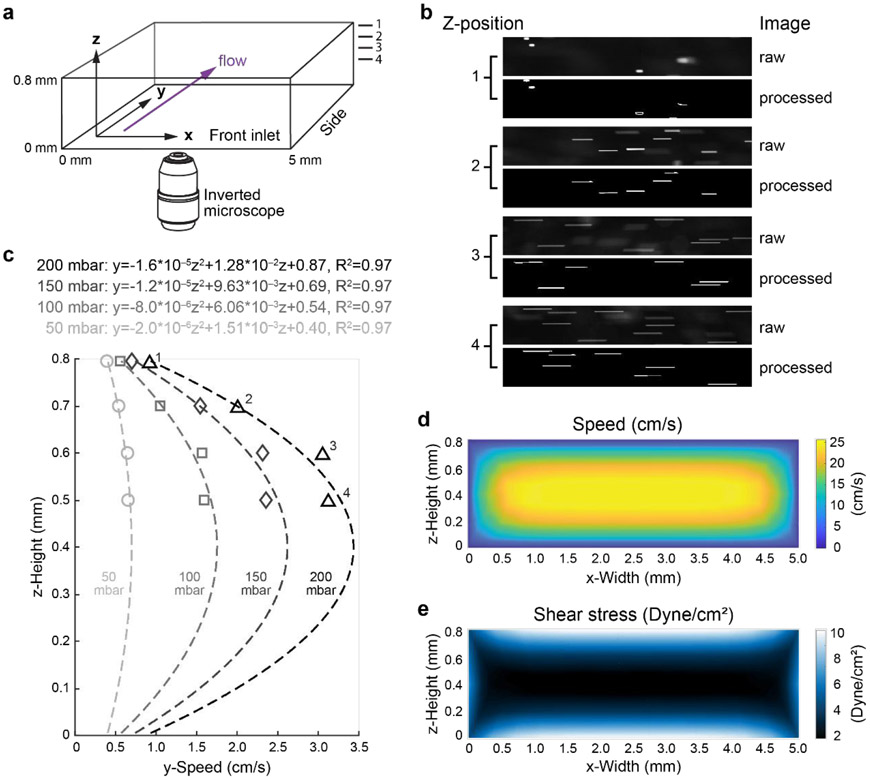
图2:荧光珠速度测量和剪切应力模拟。(a)用于流动珠条纹测量和剪切应力模拟的ibidi μ滑动通道示意图。尺寸标记。流向用紫色箭头表示。Z位置为0.8 mm,0.7 mm,0.6 mm,和0.5 mm的测量标记为“1”,“2”,“3”,“4”(b)荧光珠条纹的代表性图像(原始和图像处理步骤后,或“处理”)从z位置0.8 mm(“1”),0.7 mm(“2”),0.6 mm(“3”),和0.5 mm(“4”)在200 mbar压力下生成。(c)使用自定义算法计算不同通道z位置(1-4)的荧光珠速度。流道内的焦平面高度(单位:微米)为z。 压力已标示。计算流体动力学模拟流速(d)和剪切应力(e)在800 mbar的Elveflow泵输出分别呈现在前视图中。
剪切力由通道顶部(z深度为795 μm)的条纹长度测量值计算得出。由于流型的对称性,该剪切力值假定在通道底部(z深度为5 μm)是等效的。选择z深度为5 μm是因为这是在底部表面(0 μm)播种的EC的平均厚度,因此在长期EC分化过程中,它们将处于剪切力作用的位置。输入压力为800 mbar时,在ibidi 0.8 mm μslide中产生的剪切力约为11 dyne/cm2(图2c-e)。这些表征研究证实,Adapted-Pump系统可以产生不同水平的层流。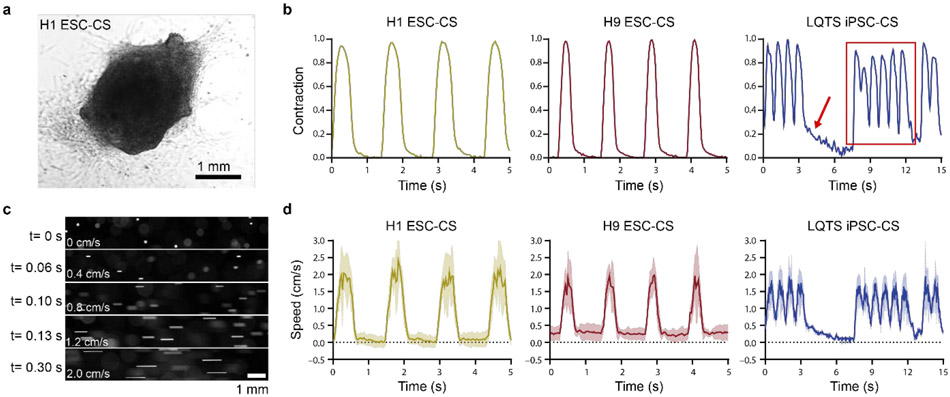
图3. hPSC-CS收缩波形和流体脉动波形的表征。(a) H1 ESC衍生的CS的代表性明场图像。(b) 通过定制算法提取的代表性hPSC-CS收缩波形的H1 ESC-CSs, H9 ESC-CSs和LQTS iPSC-CSs。峰值收缩幅度标准化为1。红色箭头表示长持续收缩,红色矩形表示***系列快速收缩。(c) 150 mbar压力从Erveflow泵发出,标准化收缩幅度为1。不同时间点流动珠子的代表性荧光显微镜图像。(d) 使用定制算法计算流动珠子的速度,由荧光显微镜下H1 ESC-CSs, H9 ESC-CSs和LQTS iPSC-CSs的脉动收缩波形驱动。波形包括平均(实线)和扫描电镜(阴影线)。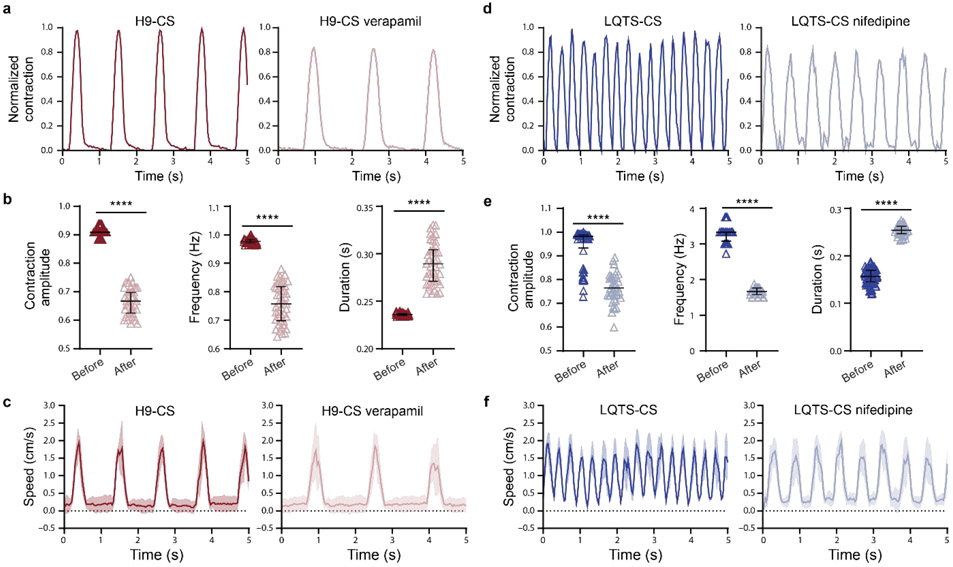
图4. 药物治疗前后hPSC-CS收缩波形和流体脉动波形的表征。(a) 用实时显微镜记录了代表性的H9 hESC-CS在1 μM verapamil治疗10分钟前后的收缩,并通过自定义算法计算。(b) 维拉帕米治疗前后H9 ESC-CS的归***化收缩幅度、收缩频率和收缩持续时间(黑线表示平均± SEM)。收缩波形由60秒内的单个收缩计算。(c) 从Erveflow泵发出150 mbar压力作为归***化收缩幅度1。用实时显微镜记录了代表性的珠速度,并通过自定义算法计算。(d) 用实时显微镜记录了代表性的LQTS iPSC-CS在1 μM硝苯地平治疗10分钟前后的收缩,并通过自定义算法计算。(e) 硝苯地平治疗前后LQTS iPSC-CS的归***化收缩幅度、收缩频率和收缩持续时间以平均± SEM表示。收缩波形由60秒内的单个收缩计算得出。(f)代表性珠速。两组之间的统计显著性由学生t检验(双尾)确定。****P<0.0001。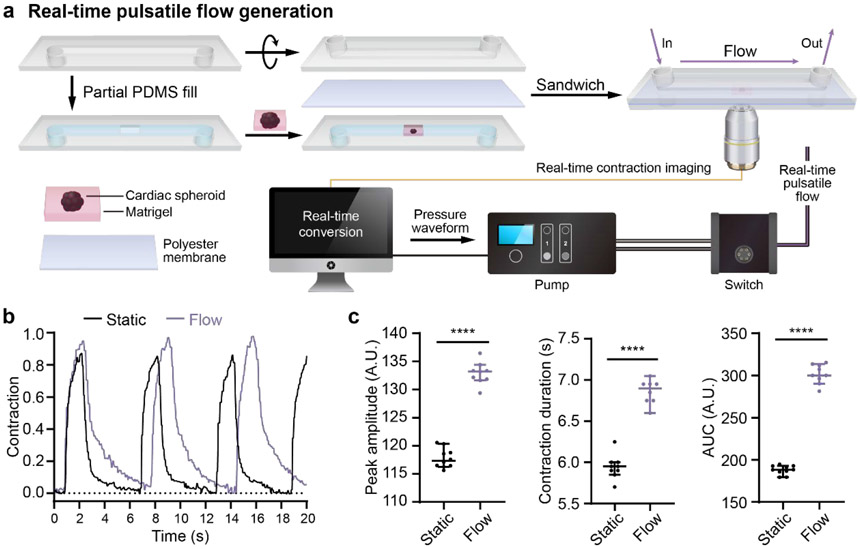
图5. hPSC-CS对流体机械刺激的响应收缩。(a)芯片心脏模型CS收缩反馈对流体机械刺激的响应示意图。CSs被嵌入Matrigel中并被镀到0.8mm ibidi sticky μ-slide的微通道中(下腔)。下腔被聚酯膜密封并覆盖另***个0.8mm ibidi sticky μ-slide(上腔)。上腔充满了CS培养基。对于静态条件下的收缩,CSs***先在向球体施加流体流动之前用明视野显微镜成像。对于流体机械刺激后的收缩响应,CSs被成像,收缩波形同时由计算机分析。脉动流信号立即被发送到泵,流体流被施加到CSs。明视野显微镜记录了球体对脉动流的响应收缩。所有信号都由定制算法分析。(b)流体流动刺激前后的代表性球体收缩波形。(c)收缩的峰值收缩幅度、收缩持续时间和曲线下面积(AUC)以均值±标准差表示。所有的收缩波形均由30秒内的单个收缩计算得出。两组之间的统计学显著性通过学生t检验(双尾)确定。****P<0.0001。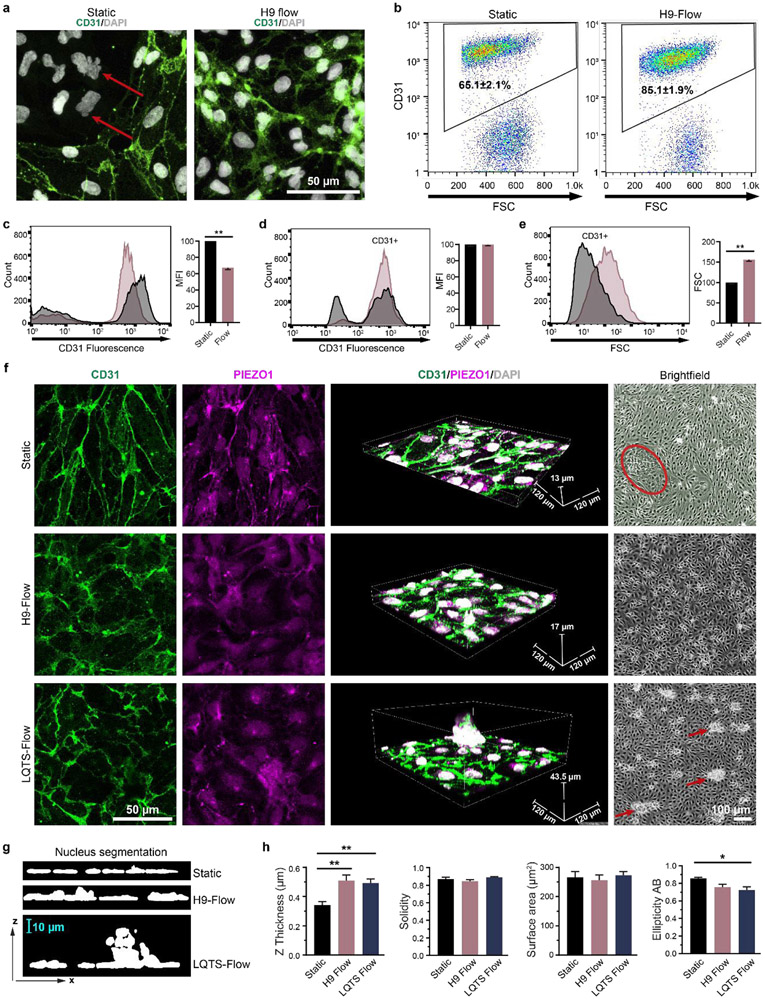
图6. 流体脉动流影响EC分化效率和形态。(a)EC祖细胞在静态条件下或hPSC来源的脉动流条件下分化,如图1c所示。分化48小时后,EC用抗CD31(绿色)和DAPI(白色)进行免疫荧光标记。红色箭头表示非内皮细胞,(b)EC种群通过流式细胞术用CD31标记从三个独立的生物复制量化,并表示为平均值± SEM。细胞外CD31表达水平通过流式细胞术在没有膜渗透性的情况下量化为CD31+种群的平均荧光强度(MFI)。统计学显著性由学生t检验(双尾)(c)确定。总CD31表达(MFI)(d)和EC大小(前向散射,FSC)(e)通过流式细胞术在膜渗透性下量化。CD31+种群被门控,并显示在直方图中。统计学显著性由学生t检验(双尾)确定。(f)静态条件下分化后的ECs,H9-CS源的脉动流条件,LQTS-CS源的脉动流条件。分化48小时后,ECs用抗CD31(绿色)和抗PIEZO1(品红色)免疫荧光标记,并用DAPI(白色)染色。标记细胞用0.5 μm Z步长成像。红色圆圈表示非内皮细胞群,红色箭头表示异常EC集群。(g,h)图像在ImageJ中重建,核形态被量化。数据收集自至少三个独立分化,并以均值±标准差绘制。统计学显著性由单因素方差分析(ANOVA)确定,然后是Tukey事后检验。*p<0.05,**p<0.01。
(文章来源于仪器网)




